关键词:气道管理;胸外科;围手术期;临床指南;推荐意见
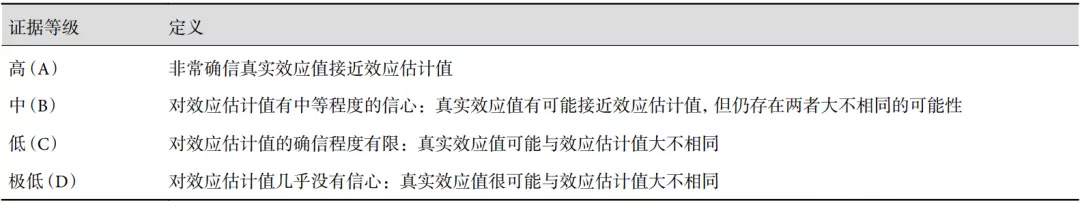
引用本文:支修益,刘伦旭,中国胸外科围手术期气道管理指南(2020 版)编写委员会. 中国胸外科围手术期气道管理指南(2020 版). 中国胸心血管外科临床杂志, 2021, 28(3). doi: 10.7507/1007-4848.202012090 1 证据与方法 根据胸外科临床实践的需要,采用德菲尔法提出 40 个临床问题,经过合并、归类,初步确定 24 个问题,由国内 32 位三甲医院胸外科专家投票,按照得票数高低,汇总并确定 12 个临床问题。检索 PubMed、Web of Science、万方、中国知网,收集每个数据库建库至 2020 年 11 月的相关研究。最终纳入 160 篇文献[1-160]。采用 GRADE 方法(表 1)评价纳入文献质量,其中 A 级 18 篇、B 级 36 篇、C 级 69 篇、D 级 37 篇。基于循证证据和临床经验,召开 4 次会议,采用 GRADE 推荐(表 2)提出 23 条推荐意见,其中强推荐 10 条,弱推荐 13 条。本指南编写从 2019 年 12 月正式启动至2020年11月,通过大纲讨论、内容撰写、内容讨论及修改、统稿、内容审校、全文通读审核,最终定稿。 表1 GRADE 证据质量分级与定义 表2 GRADE 推荐强度分级与定义 2 术前戒烟 吸烟是术后肺部感染的重要危险因素,不仅显著增加术后心肺并发症发生率,还会增加围手术期死亡风险[2-3]。 Mills 等[4]通过对 6 项随机对照试验(RCT)的 Meta 分析发现,术前戒烟可显著降低术后并发症发生率,而每多戒烟 1 周,其效果将增加 19%,且当戒烟时间≥4 周时其治疗效果有明显提高;同时对 15 项观察性研究的定量分析也发现戒烟≥4 周与<4 周相比,相对危险度(RR)降低了 20%,即戒烟时间 4 周以上效果更佳。另一项 Meta 分析[5]纳入了 14 项 RCT 和观察性研究,共 10 905 例患者,发现术前戒烟 4 周可以将术后肺部并发症的风险降低 23%(RR=0.77,95% CI 0.68~0.88),术前戒烟 8 周可将肺部并发症风险降低 46%(RR=0.54,95% CI 0.35~0.85)。 推荐:术前至少戒烟 4 周(1A)。 3 术前肺功能检测及血气分析 肺功能检测是目前胸外科手术前检查的常规项目,既能预测围手术期患者的并发症风险和远期生活质量,也能为手术决策提供客观依据。现在普遍认可的耐受肺切除术的肺功能要求如下[6-7]:全肺切除术:第 1 秒用力呼气容积(FEV1)>2 L;肺叶切除术:FEV1>1 L;肺段或楔形切除术:FEV1>0.6 L。对于高龄、身材瘦小和女性患者,由于 FEV1 绝对值会低估其手术耐受性,术后预计值 FEV1(ppoFEV1)的应用优于术前肺功能值,并能减少个体差异性[8-9],其计算公式为:ppoFEV1=术前实测 FEV1×(1–被切除有功能的肺段数量/具有功能的肺段总数)。Nakahara 等[10]发现 ppoFEV1<30% 的肺手术患者,术后死亡率高达 60%。一氧化碳弥散量(DLCO)可以反映肺气肿、肺间质疾病的严重程度,术后预计值 DLCO(ppoDLCO)计算公式与 ppoFEV1 同理。研究[11]发现 ppoFEV1% 或 ppoDLCO% 低至 30%~40% 时,术后并发症发生率会显著提高。2014 年 Ferguson 等[12]发现 ppoFEV1% 或 ppoDLCO%<30% 时,肺术后全因死亡率会显著升高。 动脉血气分析是胸外科手术常用的术前评估手段,传统上认为患者术前存在高碳酸血症[动脉血二氧化碳分压(PaCO2)>45 mm Hg]是术后不良事件的危险因素[13]。然而多项研究表明术前高碳酸血症与术后并发症风险并没有显著相关性[14-15],而术前低氧血症[脉搏血氧饱和度(SpO2)<90%]则会增加术后并发症风险[16]。因此,对于术前肺功能获得困难的患者,可将动脉血气分析作为补充评估手段。 推荐: (1)FEV1 是术前必检项目(2B)。 (2)拟行肺切除术患者,术后预计值 FEV1(ppoFEV1)和术后预计值 DLCO(ppoDLCO)是对 FEV1 的有效补充(2B)。 (3)术前动脉血二氧化碳分压(PaCO2)>45 mm Hg 不推荐作为术前风险评估指标,术前 SpO2<90% 可辅助评估手术风险(2C)。 4 术前心肺运动试验的评估 根据欧洲呼吸/胸外科医师学会(ERS/ESTS)指南和美国胸科医师学会(ACCP)指南,若 ppoFEV1% 或 ppoDLCO%<30%,建议行心肺运动试验(CPET),有助于准确评估手术风险[17-18]。CPET 过程中若最大耗氧量(VO2max)<10 mL/(kg·min),患者术后死亡率和并发症率极高[19-22],VO2max 在 10~15 mL/(kg·min)时,围手术期风险仍明显高于 VO2max>15 mL/(kg·min)的患者[23-24]。Brunelli 等[25]发现 VO2max>20 mL/(kg·min)的患者中无 1 例发生围手术期死亡。其它类似的研究也发现当 VO2max>20 mL/(kg·min)时,患者可耐受全肺切除术[21]。Benzo 等[26]一项纳入了 14 项研究共计 955 例患者的 Meta 分析显示,VO2max 值在术后并发症组低于无并发症组[(16.8±3.1)mL/(kg·min)vs.(20.0±2.7)mL/(kg·min),P<0.001]。 若 ppoFEV1% 或 ppoDLCO% 为 30%~60%,可通过简易运动试验评估心肺耐力,如登楼试验(SCT)或往返步行试验(SWT)[17-18]。SCT<14 m 的患者中有 56%(14/25)VO2max 低于 15 mL/(kg·min)[27]。Boujibar 等[28]的 Meta 分析纳入 6 项研究共计 923 例肺手术患者,结果发现 SCT<10 m 术后并发症风险较高(RR=2.34,95% CI1.59~3.43),建议进一步进行 CPET。一项纳入 125 例患者的研究[29]发现,SWT 低于 400 m 的患者中有 31.5% 的 VO2max<15 mL/(kg·min)。Fennelly 等[30]研究表明 SWT<400 m 是肺切除术后并发症的危险因素(OR=4.3,95% CI 1.4~12.7),因此 SWT<400 m 的患者建议行 CPET 评估手术风险。 心肺运动试验提示 VO2max<10 mL/(kg·min),术后并发症和死亡风险高,不建议手术;VO2max 在 10~20 mL/(kg·min)之间需要根据患者具体情况计算手术切除范围;VO2max>20 mL/(kg·min)可耐受包括全肺切除在内的手术治疗。 推荐:肺手术患者,第一秒用力呼吸容积(FEV1) 评价手术风险有困难时,建议行心肺运动试验(CPET);若不能行 CPET 时,则行登楼试验(SCT)或往返步行试验(SWT)(2B)。 5 术后气道并发症发生的高危因素 胸外科手术患者年龄偏大,合并疾病较多,手术本身对心肺功能损伤大,这些都增加了手术风险。现有研究显示,若合并以下危险因素,则围手术期气道管理的难度和手术风险明显增大。首先年龄>70 岁被研究[31-36]证实是胸外患者术后肺部并发症的独立危险因素[34-35]。其次,吸烟指数>400 年支是开胸和微创肺癌术后肺部并发症的危险因素,且是老年肺癌患者术后并发症的独立影响因素[37]。国外亦有文献[38]报道,当前吸烟者(即使 10 包年)术后呼吸系统并发症风险升高,而既往吸烟 20 包年以上者风险亦升高。此外,哮喘患者的术后并发症(肺部感染、败血症等)发生率和 30 d 院内死亡率均显著高于非哮喘患者[39]。气道高反应性(AHR)也是术前危险因素之一,尤其是术中反复的气管插管操作、术后胃食管反流、呼吸道感染、吸入刺激性化学物质等可诱发 AHR[40-42]。合并慢性阻塞性肺疾病(COPD)的患者术后发生支气管胸膜瘘、肺炎、持续漏气和机械通气时间延长等肺部并发症风险显著增高[43-44]。肥胖(BMI≥28 kg/m2或 30 kg/m2)也能显著增加肺癌术后肺部感染风险。也有研究[45]发现,体表面积(BSA)>1.68 m2是术后并发症的独立危险因素。低肺功能[46-48],呼气峰值流量(PEF)<300 L/min 亦会增加术后发生肺部感染、肺不张等并发症的风险[49-51]。致病性气道定植菌是住院患者发生医院获得性肺炎、急性呼吸窘迫综合征等并发症的重要诱发因素[52-53]。此外,营养代谢紊乱[54]和术前曾行放射治疗和/或化学治疗以及二次手术或外伤治疗史也会增加手术风险。 推荐:术后气道并发症的高危因素:年龄>70 岁、吸烟指数>400 年支、哮喘、气道高反应性、慢性阻塞性肺疾病(COPD)、肥胖或体表面积>1.68 m2、低肺功能、呼气峰值流量(PEF)<300 L/min、致病性气道定植菌、营养代谢紊乱、既往放化疗史及手术史等(2B)。 6 围手术期肺康复训练 围手术期短期肺康复训练有助于改善术前合并高危因素患者的心肺功能,并降低术后肺部相关并发症,加速患者康复[55]。国外多在门诊或社区医院进行为期 2~6 周不等的术前肺康复训练,训练频率和强度相对较低[56-58]。国内倾向于对患者术前进行为期 1 周的短期综合肺康复训练(物理康复+药物康复),可显著降低术后并发症发生率并缩短术后住院时间[59-64]。术前 PEF<300 L/min 的肺癌患者通过短期综合肺康复训练可提高 PEF,改善心肺耐力,降低术后肺部并发症发生率并缩短术后住院日[51, 59-62]。 推荐:术前合并高危因素患者,术前应至少进行为期 1 周的综合肺康复训练,肺康复训练包括物理康复和药物康复(2B)。 7 呼吸道准备及合并症药物应用 胸外科患者术前均应进行呼吸道准备,包括严格戒烟、掌握正确咳嗽方法、进行呼吸训练、保持口腔清洁等。 Silvanus 等[65]的研究表明哮喘和气道高反应患者术前使用糖皮质激素联合短效 β2 受体激动剂(SABA),可以极大降低气管插管诱发的支气管痉挛。Liccardi 等[66]提出哮喘患者术前应使用以吸入性糖皮质激素和长效 β2 受体激动剂(ICS+LABA)为基础的“5 级法”治疗方案。我国支气管哮喘防治指南[67]中指出,所有哮喘患者应在术前 5~7 d 至术后 7~12 d 进行肺康复训练以达到良好的哮喘控制。 COPD 患者术前使用 β2 受体激动剂和长效抗胆碱能药物(LAMA),可以缓解气道痉挛状态,降低气道阻力,有利于气道分泌物排出,提高肺功能和生活质量[68-71]。β2 受体激动剂可松弛气道平滑肌、增强气道纤毛运动、降低血管通透性,还可促进糖皮质激素受体易位,增加其抗炎作用,与吸入性糖皮质激素联用具有协同作用[72-73]。抗胆碱能药物通过阻断 M 受体松弛气道平滑肌,抑制黏液分泌,与 β2 受体激动剂具有互补作用。吸入性糖皮质激素可以直接作用于气道黏膜,减轻肺水肿、提高气管插管耐受性、抑制炎症因子释放、减少气道分泌物[74-75]。围手术期联合使用吸入性糖皮质激素和支气管扩张剂能够有效提高患者呼吸功能[76-77],使用三联(ICS+LABA+LAMA)比二联(LABA+LAMA)可以更好地改善肺癌合并 COPD 患者的肺功能和术后结局[78]。 气道分泌物较多者使用黏液溶解剂可促进患者排出呼吸道内黏稠分泌物,减少黏液滞留,改善患者呼吸功能,减轻手术操作造成肺部的炎症反应[79-81]。系统评价[82]显示,术前预防性使用黏液溶解剂可有效减少术后肺部并发症的发生。围手术期常用黏液溶解剂有雾化吸入类、口服类、静脉输注类。 肺部手术患者术前致病性气道定植菌检出率为 18%~37% [83-87],吸烟和 COPD 是发生气道致病性定植菌最重要的影响因素[88]。一项关于肺癌手术患者气道定植菌的 Meta 分析[52]研究发现,致病性气道定植菌是术后肺部感染的独立危险因素(OR=2.44,95% CI1.45~4.11)。术前明确合并气管定植菌的患者,应根据细菌培养和药敏结果合理使用抗生素。 推荐: (1)胸外科患者术前均应进行呼吸道准备(1B)。 (2)术前合并哮喘、气道高反应、COPD 的患者,围手术期使用吸入性糖皮质激素和支气管扩张剂(如 ICS+LABA 或 ICS+LABA+LAMA)(1B)。 (3)气道分泌物较多者围手术期应使用黏液溶解剂(1B)。 (4)术前合并致病性气管定植菌的患者,应合理使用抗生素(2C)。 8 围手术期给药方式选择 围手术期吸入装置的选择与患者的实际情况有关,包括患者的年龄、认知状况、手口动作的协调性以及疾病的严重程度。气道管理的给药方式有静脉、口服、吸入等。吸入给药方式可以使药物以气溶胶形式直接作用于呼吸道,相较于口服和静脉给药,吸入给药起效快、局部药物浓度高、用量少,可减少全身不良反应。吸入给药设备有便携式吸入装置和雾化吸入器两类,便携吸入装置包括压力定量吸入器(传统 pMDI 以及共悬浮技术新型 pMDI)、干粉吸入器(DPI)、软雾吸入器(SMI);雾化吸入装置包括喷射雾化器、超声波雾化器、振动筛孔雾化器[89-90]。 雾化给药对于围手术期部分年老体弱或婴幼儿、吸气流速极低、疾病程度较重的患者是更佳选择。尤其术后初期,患者因疼痛、无力、气道水肿等原因无法用力吸气,更适合雾化吸入治疗[91-94]。目前雾化吸入制剂包括糖皮质激素、支气管扩张剂、黏液溶解剂等,根据患者病情不仅可以两联到四联药物同时雾化,还可满足机械通气患者吸入治疗的需求,增加了临床使用的灵活性和简便性[95]。另一方面,便携式吸入装置携带方便,能反复定量给药,更便于院外使用[96]。传统 pMDI 对于使用者的手口操作协同有较高要求,药物大部分沉积在口咽部。DPI 则操作简便,患者协同性较好,但需要一定的吸气流速,部分老年或儿童呼吸较衰弱故使用受限[90]。采用共悬浮技术(Aerosphere)的新型 pMDI,使用直径约 3 μm 药物颗粒,在装置内形成一种稳定悬浮物,对于吸气流速要求低,改善了患者用药便捷性,肺部沉积率可高达 48%,有益于提高依从性和治疗效果[97-100]。 推荐: (1)围手术期部分年老体弱或婴幼儿、吸气流速极低的患者,或术后初期,因疼痛、无力、气道水肿等原因无法用力吸气的患者,推荐使用雾化吸入治疗(2C)。 (2)围手术期病情平稳、呼吸有力、能够主动配合吸入治疗的患者,或对于便携性有一定要求的患者(如院外),建议使用便携吸入装置治疗(2C)。 9 术中麻醉管理措施 胸科手术术中麻醉管理主要达到 2 个目标:减轻局部(肺)和全身炎症反应;尽早拔除气管导管,从而减少术后肺部并发症,有利于患者及早下床活动,加快术后康复[101]。 麻醉维持:麻醉维持采用短效麻醉药物有利于术后尽快拔管[114]。吸入麻醉(七氟烷或地氟烷)和以丙泊酚为主的静脉麻醉都可作为胸科手术的麻醉维持方式[102,114]。全身麻醉联合区域麻醉也有利于麻醉苏醒和尽快拔管[114]。采用脑电双频指数(BIS)和肌松监测维持恰当的麻醉深度和肌松深度有利于术后尽快拔管[101, 103-104]。 肺隔离[114]:大多数胸科手术都需要肺隔离和单肺通气,以利于手术操作。多采用双腔支气管导管(DLT)进行肺隔离。选择恰当大小的 DLT 以及硅胶 DLT 可减轻气道损伤和术后咽痛。当存在困难气道造成 DLT 插管困难时,支气管封堵管可能是更好的选择。无论采用DLT和支气管封堵管进行肺隔离,都推荐使用纤维支气管镜进行定位。 通气管理:通常采用肺保护性通气策略。双肺通气时,使用小潮气量 6~8 mL/kg(预测体重)、恰当 PEEP 和肺复张手法[101]。在单肺通气前,给予100% FiO2,可加快手术侧肺塌陷[114]。单肺通气时,设置潮气量4~6 mL/kg(预测体重)[105]、PEEP 5~10 cm H2O[114]。气道峰压不超过30 cm H2O,气道平台压不超过20 cm H2O[105]。二氧化碳分压通常维持在35~45 mm Hg[102](个别情况下可维持在40~60 mm Hg[105])。近来,有研究显示,以驱动压为导向的通气策略可能更优[106]。通气模式采用容量控制和压力控制通气均可,但存在发生肺损伤高危因素时,建议首先压力控制通气[105]。给予维持 SpO2>92%的最低 FiO2[101]。 推荐: (1)麻醉维持:吸入麻醉和静脉麻醉均可,推荐选择短效药物(2C)。 (2)推荐术中使用麻醉深度和肌肉松驰深度监测(1A)。 (3)推荐保护性通气策略(2A)。 10 胸腔引流管管理 胸腔引流管留置主要作用是维持胸腔负压,引流术后胸腔积气、积液[107]。术后常规需留置引流管,应在无漏气、肺复张良好的情况下早期拔除引流管。Zhou 等[108]通过纳入 5 项 RCT 进行的 Meta 分析显示肺叶切除术后使用单根胸腔引流管是安全有效的,术后并发症发生率(P=0.67)和再置管率(P=0.54)没有升高,且患者疼痛明显减轻(P<0.001)、引流时间(P<0.001)和住院时间(P=0.01)也明显缩短。另有研究[109-112]表明,单管或细管(14F、16F、18F)引流效果不劣于双管或粗管引流,且有助于患者术后早期活动、减少引流量、增加舒适度,并有利于引流管伤口愈合。对于胸腔广泛粘连的患者,术后推荐留置两根闭式引流管[113-114]。此外,留置胸腔引流管无需常规进行负压吸引[115-118],术后在无肺部漏气情况下,应尽早拔除引流管,Zhang 等[119]开展的 Meta 分析结果表明建议 24 h 引流量<300 mL 拔管是较为安全的(需排除乳糜液及出血)。另一项 Meta 分析[120]发现数字化引流系统能够明显减轻肺漏气(P<0.001)、缩短引流时间(P<0.001)和住院时间(P<0.001),对于动态监测胸腔引流情况及指导早期拔管具有一定优势。无水负压引流器在达到相同的引流和观察效果的同时,也可缩短患者术后住院时间,对患者术后快速康复有较好的作用[121]。 推荐: (1)胸腔内手术后推荐常规留置引流管,无粘连者可置单根小管径胸腔引流管引流(1B)。 (2)术后不推荐常规进行负压吸引,术后无漏气、24 h 引流量<300 mL 即可拔管(1B)。 (3)数字化引流系统和无水负压引流器可缩短拔管时间(2B)。 11 术后咳嗽评估与处理 肺切除术后持续咳嗽是指肺切除术后持续时间不少于 2 周的干咳,胸部 X 线无异常,且排除鼻后滴流综合征、支气管哮喘等因素,其发生率为 25%~50%[122]。术后持续咳嗽会加重切口疼痛,干扰患者交谈及睡眠,严重影响患者生活质量。肺切除术后咳嗽的机制仍存在争议,可能与支气管牵拉、支气管内缝线暴露、淋巴结清扫、膈肌抬高、胃食管反流等因素有关[122]。Xie 等[123]回顾分析了 171 例行肺叶切除术的肺癌患者资料,发现右肺癌、困难气道、急性咳嗽和 COPD 史是术后持续咳嗽的独立预测因素。 术后咳嗽的评估主要从严重程度、发生频率以及健康相关生活质量 3 个方面进行,其中评估健康相关生活质量的有效工具是莱斯特咳嗽量表(LCQ)[124]。Gao 等[125]将 LCQ 量表翻译成中文版,即 LCQ-MC,其由生理、心理和社会 3 个维度的 19 个项目组成,分数越高表示咳嗽程度越轻。林嵘嘉[126]等对 LCQ-MC 进行了改良和验证,以更加适合肺癌术后咳嗽评估。 Sawada 等[127]对肺切除术后持续咳嗽的患者,使用吸入糖皮质激素加 β2 受体激动剂进行经验性治疗被证实有效,且无严重的副作用。Miyamoto 等[128]认为肺叶切除术后持续咳嗽是由 C 纤维激活引起的,抑制 Th2 细胞因子产生的抗过敏药甲磺司特可以缓解肺切除后持续咳嗽症状。对于术后存在胃食管反流症状的患者出现的持续性咳嗽,质子泵抑制剂和促胃肠动力药物有助于缓解咳嗽症状;对于急性期咳嗽,可待因类药物可能有效,但对于术后亚急性和慢性咳嗽效果有限[129]。对于术后严重咳嗽有气道高反应症状,临床怀疑为咳嗽变异性哮喘的患者,应完善支气管激发试验或舒张试验,明确诊断后使用吸入性糖皮质激素联合支气管舒张剂能有效缓解咳嗽症状[130-131]。 推荐: (1)术后持续咳嗽严重影响患者生活质量,推荐采用 LCQ-MC 量表来评估严重程度(1B)。 (2)术后持续咳嗽患者,可考虑使用吸入性糖皮质激素和支气管扩张剂治疗(2C)。 12 围手术期疼痛管理 术后疼痛限制患者体位变化、无法有力或有效咳嗽,痰液及气道内分泌物不能充分排出,从而增加肺不张和肺部感染的发生风险[114,132-134]。 疼痛管理是保证术后镇痛效果的重要环节,在实施时应强调个体化镇痛,提倡预防性镇痛和多模式镇痛联合应用[135]。以选择性环氧化酶(COX)-2 抑制剂、非选择性非甾体类抗炎药(NSAIDs)[136-141]或对乙酰氨基酚[142-144]作为多模式镇痛基础方案,减少阿片类药物的应用,可以联合采用患者自控镇痛(PCA)泵、伤口局部浸润、肋间神经阻滞和椎旁阻滞等多种方式[145-146]。 推荐:围手术期疼痛管理推荐采用预镇痛、多模式镇痛方案(1A)。 13 静脉血栓及肺栓塞预防 静脉血栓栓塞(VTE)是患者术后住院期间的常见并发症和围手术期死亡原因[147-148]。食管癌及肺癌均是术后静脉血栓栓塞发生的独立危险因素[149-151]。胸外科术后深静脉血栓形成(DVT)的发生率为 0.4%~51%,肺栓塞发生率为 1%~5%,其中有 2% 的患者甚至会遭遇致死性肺栓塞[152-153]。国内文献[154]报道,胸外科大手术术后 VTE 的总体发生率为 13.9%,其中肺恶性肿瘤为 16.4%,VTE 多发生于术后 1 周内。因此胸外科手术患者应当被认为是术后发生静脉血栓栓塞的高危人群,而对患者进行个体化的 VTE 风险评估可使用改良 Caprini 风险评估量表[155-156]。 在患者入院时即应对其进行 VTE 风险宣教,并将血脂及血糖控制在合适范围内。鼓励患者术后尽早下床活动,自主的腿部运动(如抬腿)有助于预防下肢 DVT。对于病情严重、手术创伤大、活动困难或需要长期卧床的患者,可借助外力辅助进行被动腿部运动[157-158]。ACCP 推荐机械性 VTE 预防措施[如使用梯度弹力袜,间歇性充气加压装置(IPC)和足部脉冲装置]应在患者入院时至术后完全恢复自主活动期间使用[159]。对于大出血风险低的患者,应当加用低分子肝素(LMWH)或肝素(对肾功能不佳的患者)进行药物预防。对于大出血高风险患者,则建议联合使用弹力袜和 IPC 进行机械性预防[160]。 推荐:拟行胸外科手术的患者,推荐术前进行 VTE 风险宣教,并使用药物及机械性 VTE 预防措施(1B)。 14 小结 “围手术期气道管理”理念应用于临床实践 10 年来取得了良好效果,但在临床上仍存在一些问题,比如高危人群识别与诊断、相关学科医护人员对围手术期气道管理理念的认知、用药时机以及时限、患者依从性等仍有待进一步提高或明确。鉴于此,我们在 2018 年版专家共识基础上,依据近年来新的临床实践和文献检索,对共识内容进行了拓展和升级,制定了《中国胸外科围手术期气道管理指南 2020 版》。希望该指南能引导胸外科、呼吸科、麻醉科、疼痛科、康复科等多学科协作,共同推进临床多中心研究,获取更多的临床研究数据,使得围手术期气道管理方案在临床实践中更加完善。 利益冲突:无。 中国胸外科围手术期气道管理指南(2020 版)编写委员会名单 主编:支修益(首都医科大学宣武医院)、刘伦旭(四川大学华西医院) 执笔:车国卫(四川大学华西医院)、胡坚(浙江大学医学院附属第一医院) 成员(按姓氏汉语拼音排序):蔡开灿(南方医科大学南方医院)、陈椿(福建医科大学附属协和医院)、陈军(天津医科大学总医院)、陈铭伍(广西医科大学第一附属医院)、高文(复旦大学附属华东医院)、何建行(广州医科大学附属第一医院、广州呼吸健康研究院)、胡雯(四川大学华西医院)、姜格宁(同济大学附属上海市肺科医院)、姜杰(厦门大学附属第一医院)、李辉(首都医科大学附属北京朝阳医院)、李单青(北京协和医院)、刘德若(首都医科大学附属中日友好医院)、刘俊峰(河北医科大学第四医院)、刘雪梅(四川大学华西医院)、刘阳(中国人民解放军总医院)、刘永煜(沈阳市胸科医院)、田辉(山东大学齐鲁医院)、王群(复旦大学附属中山医院)、魏立(河南省人民医院)、谢薇(四川大学华西医院)、许顺(中国医科大学附属第一医院)、薛涛(东南大学附属中大医院)、杨跃(北京大学肿瘤医院)、余海(四川大学华西医院)、张百江(山东省肿瘤医院)、张春芳(中南大学湘雅医院)、张兰军(中山大学附属肿瘤医院)、赵珩(上海市胸科医院)、郑劲平(广州医科大学附属第一医院、广州呼吸健康研究院)、周燕丰(浙江大学医学院附属第一医院) 参考文献略

来源:中国胸心血管外科临床杂志
作者:支修益1 刘伦旭2
单位:1首都医科大学宣武医院 胸外科 2 四川大学华西医院 胸外科



 浙公网安备 33049802000270号
浙公网安备 33049802000270号